
科目: 来源: 题型:实验题
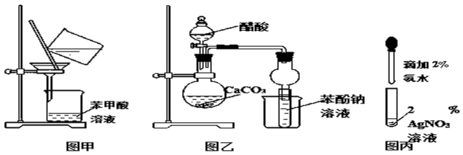
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
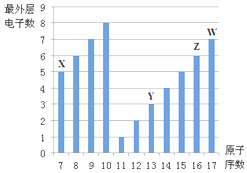 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.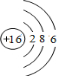 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
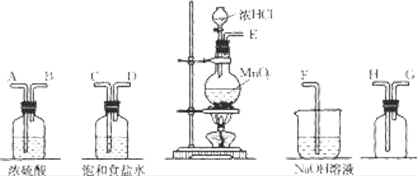
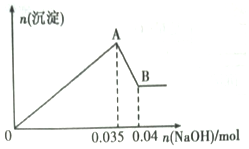
查看答案和解析>>
科目: 来源: 题型:解答题
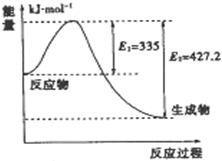 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com