
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
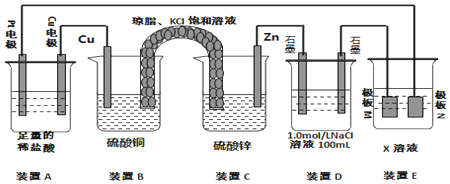
查看答案和解析>>
科目: 来源: 题型:解答题
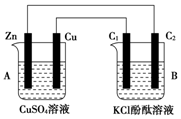 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
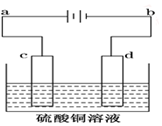 电解装置如图所示:
电解装置如图所示:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目: 来源: 题型:实验题
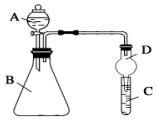 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:推断题
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com