
科目: 来源: 题型:实验题
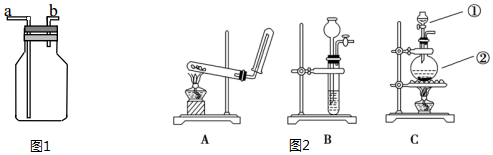
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
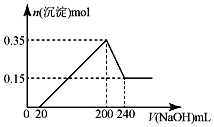 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 氧化物 | 环境问题 | 主要来源 | |
| A | CO2 | 酸雨 | 化石燃料的燃烧 |
| B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
| C | NO2 | 温室效应 | 工厂废气的排放 |
| D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
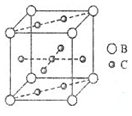 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com