
科目: 来源: 题型:解答题
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
查看答案和解析>>
科目: 来源: 题型:选择题
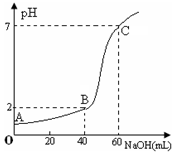 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图象如下.下列说法正确的是( )| A. | 若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{m+1}$ | |
| B. | 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH | |
| C. | 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO) | |
| D. | b~c段,随NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c=$\frac{b}{11.2V}$ | B. | p=m+$\frac{{V}_{c}}{125}$ | C. | n=m+17Vc | D. | $\frac{17}{9}$m<p<$\frac{5}{3}$m |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的PH=7,则混合溶液中c(CH3COO-)>c(Na+) | |
| C. | 如果混合溶液的PH<7,则a1b1=a2b2 | |
| D. | 如果a1=a2,且混合溶液的PH<7,则b1>b2 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com