
科目: 来源: 题型:选择题
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
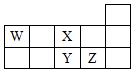
| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |
查看答案和解析>>
科目: 来源: 题型:多选题
 世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )
世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )| A. | a极发生还原反应 | |
| B. | 正极的电极反应式为FeOx+2xe-═Fe+xO2- | |
| C. | 若有22.4L(标准状况)空气参与反应,则电路中转移4mol电子 | |
| D. | 铁表面发生的反应为xH2O(g)+Fe═FeOx+xH2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn、CuO | B. | Fe、Al2O3 | C. | Fe、CuO | D. | Cu、FeO |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
 | 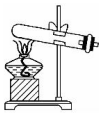 |  |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |
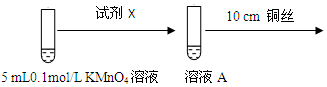
| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
| X | Y | |
| Z | W |
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com