
科目: 来源: 题型:选择题
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
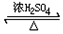 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3与足量Ca(OH)2的反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO${\;}_{{3}_{\;}^{\;}}^{2-}$+2H2O | |
| B. | 少量Na投入冷水中;Na+2H2O═Na++OH-+H2↑ | |
| C. | CuSO4与Ba(OH)2的反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | AlCl3溶液中加入足量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z位于周期表第三周期第ⅦA族 | |
| B. | 简单离子半径由大到小排序:Z、T、X、Y | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | R2T2和X2T2中所含化学键类型完全相同 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com