
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
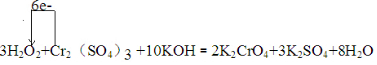 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 | |
| B. | 对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原 0.1molCr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
查看答案和解析>>
科目: 来源: 题型:填空题
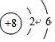 ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为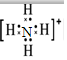 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com