
科目: 来源: 题型:解答题
 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目: 来源: 题型:实验题
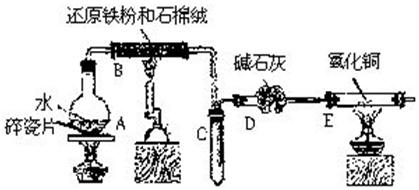
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
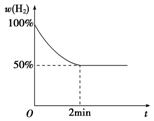
科目: 来源: 题型:选择题
 向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )| A. | OA段产生的是NO和H2的混合气 | B. | BC段产生的全部是NO | ||
| C. | Fe2(SO4)3是最终的溶质 | D. | H2SO4的物质的量浓度是2 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.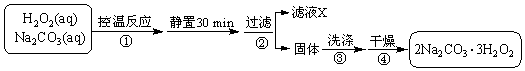
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com