
科目: 来源: 题型:选择题
| A. | 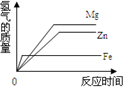 | B. | 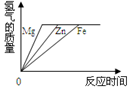 | C. | 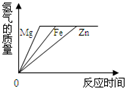 | D. | 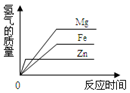 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
查看答案和解析>>
科目: 来源: 题型:解答题
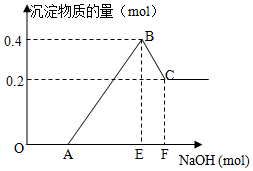 在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图查看答案和解析>>
科目: 来源: 题型:实验题
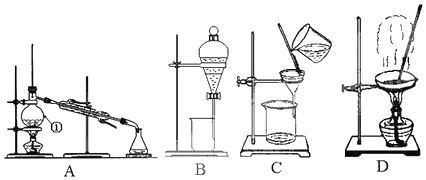
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中硫元素被氧化,所有铁元素均被还原 | |
| B. | 当转移1mol电子时,46 g CuFeS2参加反应 | |
| C. | 氧化产物是S,还原产物是Cu2+和Fe2+ | |
| D. | 还原剂是S2-,氧化剂是Fe3+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
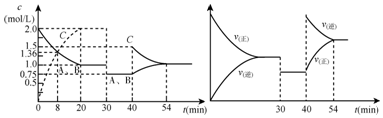
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.16mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目: 来源: 题型:填空题
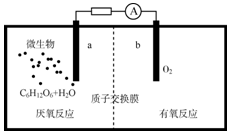
查看答案和解析>>
科目: 来源: 题型:实验题
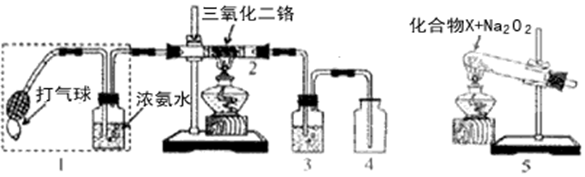
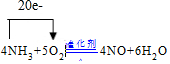 .
.查看答案和解析>>
科目: 来源: 题型:选择题
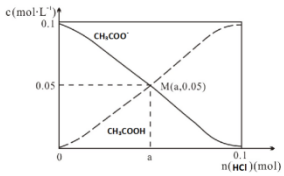
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com