
科目: 来源: 题型:选择题
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
查看答案和解析>>
科目: 来源: 题型:选择题
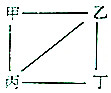 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最大 | |
| D. | W的最高化合价为+7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体,熔点和硬度都很高 | |
| B. | 氕、氘、氚是氢元素的三种核素,质子数都是1 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
查看答案和解析>>
科目: 来源: 题型:解答题
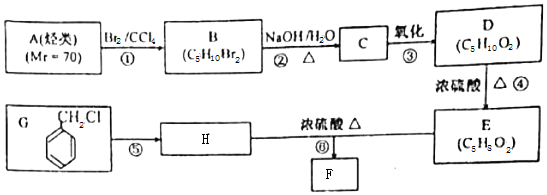
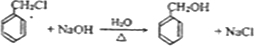 .
. .
.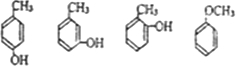 写出其中一种.
写出其中一种.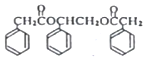 .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)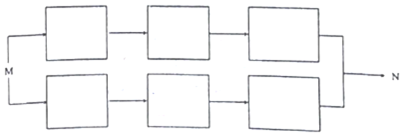
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
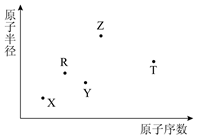 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )| A. | 最高价氧化物对应水化物的酸性R>T | |
| B. | 氢化物的沸点一定是Y>R | |
| C. | 原子半径和离子半径均满足Y<Z | |
| D. | 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键 |
查看答案和解析>>
科目: 来源: 题型:实验题
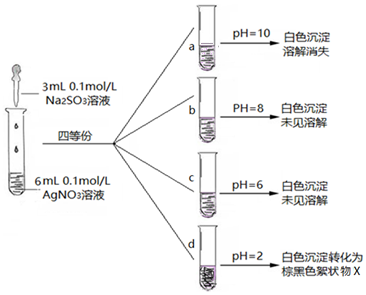
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com