
科目: 来源: 题型:解答题
 根据已学物质结构与性质的有关知识,回答下列问题:
根据已学物质结构与性质的有关知识,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol | |
| B. | 参加反应的金属的总质量 3.6 g<m<9.6 g | |
| C. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=200 mL | |
| D. | 当金属全部溶解时收集到NO气体的体积在标况下为 2.24 L |
查看答案和解析>>
科目: 来源: 题型:解答题
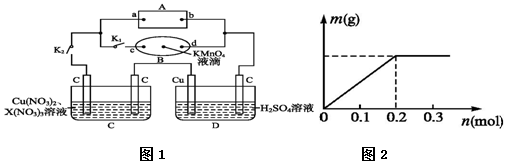
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
查看答案和解析>>
科目: 来源: 题型:选择题
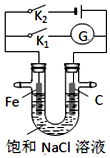
| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
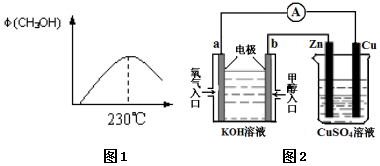 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
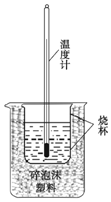 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:| 反应物 | 起始温度(℃) | 终了温度(℃) | 中和热(kJ•mol-1) |
| ①HCl+NaOH | 13 | 19.8 | -a |
| ②HCl+NH3•H2O | 13 | 19.3 | -b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com