
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
查看答案和解析>>
科目: 来源: 题型:解答题
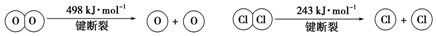
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 | |
| B. | 使用填埋法处理未经分类的生活垃圾 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 加速建设地铁、轻轨等轨道交通,促进武汉“8+1”城市圈-体化发展,减少汽车尾气排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
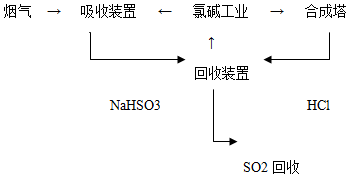
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2?Fe(SO2)63+(反应b) | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  用于分离I2和NH4Cl | |
| B. |  用于测定某稀盐酸的物质的量浓度 | |
| C. | 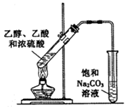 加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯 | |
| D. |  滴入浓硫酸后,KMnO4溶液褪色,说明浓硫酸起到了脱水剂和氧化剂的作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: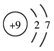 | D. | -OH的电子式: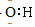 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com