
科目: 来源: 题型:实验题
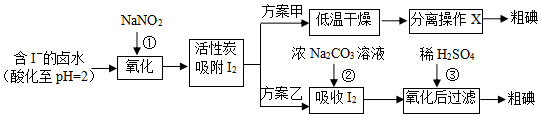
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 转化①有利于碳参与自然界的元素循环 | |
| B. | 转化②中S和O2属于不同的核素 | |
| C. | 可用澄清的石灰水鉴别CO2与SO2 | |
| D. | 转化的热化学方程式是:2CO(g)+SO2(g)═S(s)+2CO2 (g)△H=+270kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,H2S浓度增加,表明该反应的△H>0 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

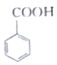 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$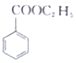 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
查看答案和解析>>
科目: 来源: 题型:解答题
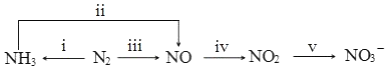
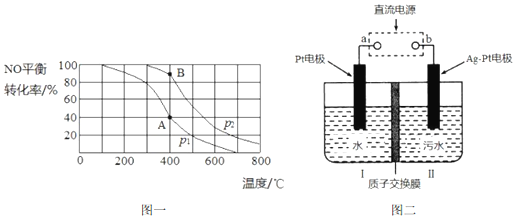
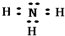 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
查看答案和解析>>
科目: 来源: 题型:实验题
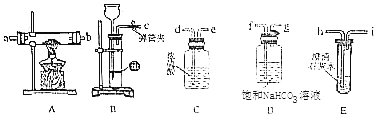
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| C. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| D. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com