
科目: 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
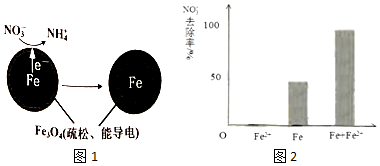
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目: 来源: 题型:实验题
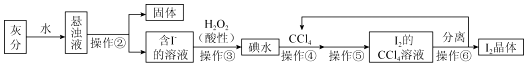
查看答案和解析>>
科目: 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
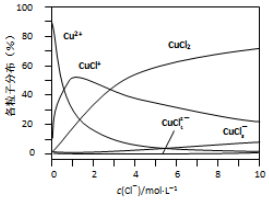
查看答案和解析>>
科目: 来源: 题型:实验题
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
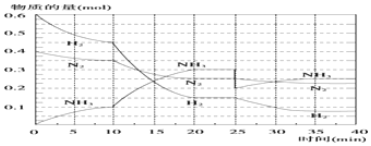
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com