
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 诜项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入浓硝酸 | 比较Fe和Cu的金属活动性 |
| D | 将铁钉放入试管中,下端浸入食盐水中 | 验证铁的吸氧腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
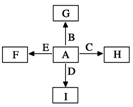 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物. ,它的空间构型是直线型分子;
,它的空间构型是直线型分子;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 | |
| B. | 一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA | |
| C. | 常温下18 g铝放入足量浓硫酸中转移电子数2 NA | |
| D. | 1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com