
科目: 来源: 题型:选择题
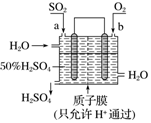
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
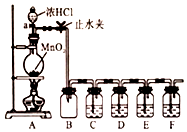 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m=8.7 g | |
| B. | 反应过程中转移电子总数为0.1 NA | |
| C. | 反应过程中起氧化性作用的n(HCl)=0.2mol | |
| D. | 滤液中盐酸的浓度为$\frac{2}{3}$ mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)
(1)如图是一种常见有机物的比例模型,该模型图可代表一种D(填代号,下同)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com