
科目: 来源: 题型:解答题
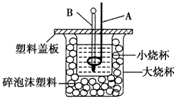 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 一定温度下冰转化为水是自发的化学反应 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 同一物质的固液气三种状态的熵值相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 保持温度和容器体积不变,充入 1 mol SO3(g) | |
| B. | 保持温度和容器内压强不变,充入 1 mol SO3(g) | |
| C. | 保持温度和容器内压强不变,充入 1 mol O2(g) | |
| D. | 保持温度和容器内压强不变,充入 l mol Ar(g) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.68 g | B. | 6..68 g | ||
| C. | 2.34 g | D. | 由于m未知,无法计算 |
查看答案和解析>>
科目: 来源: 题型:实验题
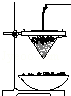 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目: 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com