
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
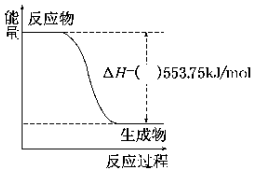 广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊A |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 35 | 数据模糊B |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊C |
| 7 | 0.10 | 丝 | 1.0 | 50 | 数据模糊D | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 未测数据 | 40 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):加一些水、过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| A. | 5.7×10-18 mol•L-1 | B. | 2.6×10-5mol•L-1 | ||
| C. | 1.6×10-13mol•L-1 | D. | 5.7×10-24mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学家哈伯用催化法合成氨后,就能生产硝酸铵 | |
| B. | 化学家合成碳纳米管,用作分子导线和超小型电子器件 | |
| C. | 俄国科学家门捷列夫发现元素周期律 | |
| D. | 诺贝尔用硝化甘油制成了炸药,并用于工业生产 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
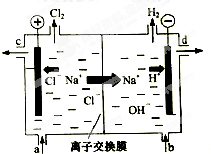 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(N2)=0.7 mol•L-1•min-1 | ||
| C. | v(NH3)=0.2mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
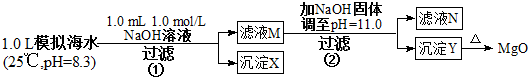
| 海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3,MgCO3 | |
| B. | 滤液M中存在Mg2+,不存在Ca2+ | |
| C. | 滤液N中存在Mg2+、Ca2+ | |
| D. | 步骤②中若改为加入8 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com