
科目: 来源: 题型:选择题
| A. | 常温常压下,7.8g Na2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2LSO3中含有的分子数目为0.5 NA | |
| C. | 常温常压下,46gNO2与 N2O4的混合气体含有的氮原子数目无法计算 | |
| D. | 0.1 mo1•L-1 MgC12溶液中含有的Mg2+数目小于0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
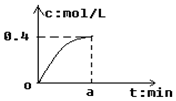 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) (△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)(△H=+57.3 kJ/mol (中和热) | |
| C. | S(s)+O2(g)=SO2(g) (△H=-269.8 kJ/mol (反应热) | |
| D. | 2NO2=O2+2NO (△H=+116.2 kJ/mol (反应热) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在Fe(OH)3胶体中加入HI溶液:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 标准状况下将112ml氯气通入6ml 1mol/L的碘化亚铁溶液中3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| C. | 向澄清石灰水中加入足量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+═Cu2++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 1molC8H18分子中含有的共用电子对数为26NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加入少量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 少量CO2通入苯酚钠溶液:2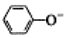 +CO2+H2O→2 +CO2+H2O→2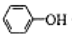 +CO32- +CO32- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:实验题
| 装置 | 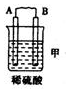 | 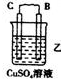 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com