
科目: 来源: 题型:选择题
| A. | S2Cl2的结构式为Cl-S-S-Cl | |
| B. | S2Cl2中S原子的杂化类型为sp2杂化 | |
| C. | S2Cl2分子中各原子核外最外层电子均达到8电子稳定结构 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
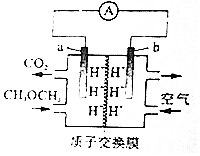
| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |
查看答案和解析>>
科目: 来源: 题型:选择题
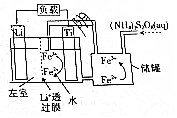
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
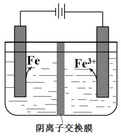
| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目: 来源: 题型:实验题
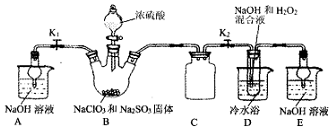
查看答案和解析>>
科目: 来源: 题型:解答题
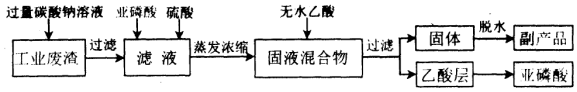
查看答案和解析>>
科目: 来源: 题型:解答题
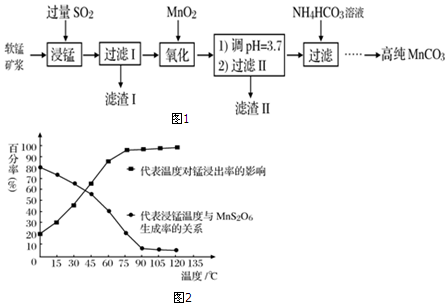
查看答案和解析>>
科目: 来源: 题型:解答题

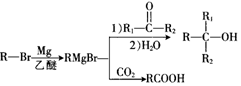
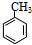 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$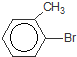 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应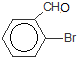
 ,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
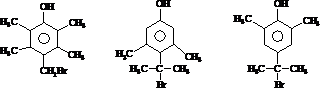
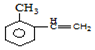 )的路线流程图(其他试剂任选)
)的路线流程图(其他试剂任选)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com