
科目: 来源: 题型:选择题
| A. | 电泳现象可证明胶体带电 | |
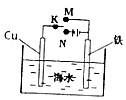
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
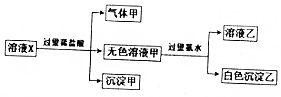 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
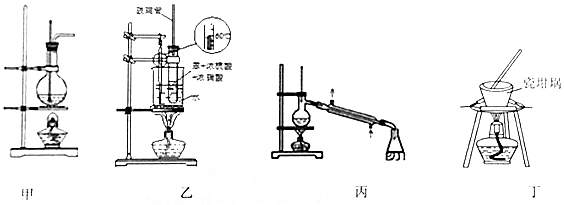
| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤⑧⑨⑩ | B. | ②③⑥⑦⑨ | C. | ②③⑥⑦ | D. | ④⑤⑧⑨ |
查看答案和解析>>
科目: 来源: 题型:解答题
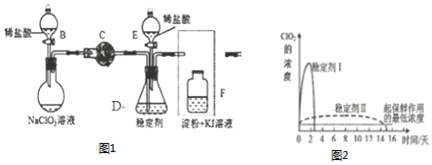
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
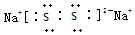 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目: 来源: 题型:选择题
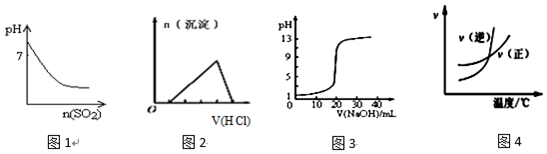
| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
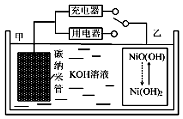 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极反应为:NiO(OH)+H2O+e?═Ni(OH)2+OH? | |
| B. | 放电时,甲电极为正极,OH?移向乙电极 | |
| C. | 电池总反应为H2+2NiO(OH)$?_{放电}^{充电}$ 2Ni(OH)2 | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol/L 的硫酸铵溶液中:c(NH4+)>c(SO42?)>c(H+)>c(OH?) | |
| B. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(OH?)+c(HCO3?)+2c(H2CO3) | |
| C. | pH之和为14的H2C2O4与KOH 溶液混合:c(K+)>c(H+)>c(OH?)>c(HC2O4?) | |
| D. | pH=5 的H2S溶液中,c(H+)>c(HS?)=1×10-5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com