有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂.纯E为无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同.现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO
3,沉淀均不溶;
④将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出.
根据上述实验信息,请回答下列问题:
(1)A溶液中存在的化学平衡为
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
;A与D溶液混合发生反应的离子方程式为
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+(或2NH3?H2O+Mg2+═Mg(OH)2↓+2NH4+)
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+(或2NH3?H2O+Mg2+═Mg(OH)2↓+2NH4+)
.
(2)C溶液中溶质的化学式为
BaCl2
BaCl2
;F溶液中溶质的化学式为
AgNO3
AgNO3
.
(3)不能确定的溶液是(写出溶液标号与可能相应溶质的化学式)
B:Na2CO3或K2CO3,D:Al2(SO4)3或MgSO4
B:Na2CO3或K2CO3,D:Al2(SO4)3或MgSO4
,进一步鉴别的方法是
用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液;
取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.
用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液;
取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.
.


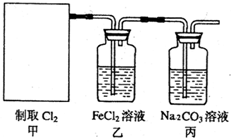 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.