
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
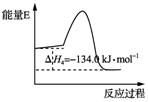 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| m | n | ||
| x | y |
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加碳酸氢钠溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | Fe(NO3)3溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 酸性KMnO4溶液与H2O2反应证明H2O2具有还原性:MnO4-+10H++H2O2═2Mn2++6H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢化物的稳定性:B>C | |
| B. | 氢化物的沸点:B>C | |
| C. | 最高价氧化物对应的水化物的酸性:B>D | |
| D. | A、B、C、D形成的单质最多有6 种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com