
科目: 来源: 题型:选择题
| A. | 向CuSO4溶液中加入适量铁粉 | |
| B. | 等物质的量浓度、等体积的Ca(HCO3)2与NaOH溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 在NaBr、NaI的混合液中通入过量氯气 |
查看答案和解析>>
科目: 来源: 题型:实验题
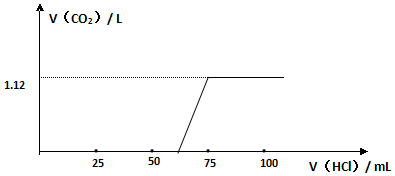
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
查看答案和解析>>
科目: 来源: 题型:推断题
 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb;C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb;C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.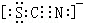 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
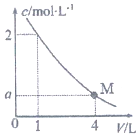 如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )
如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )| A. | 0.25mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 2mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,如图为病人输液用的葡萄糖(化学式为C6H12O6)注射液标签上的部分內容(该注射液就是葡萄糖的水溶液).试根据标签上的有关数据回答下列问题:
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,如图为病人输液用的葡萄糖(化学式为C6H12O6)注射液标签上的部分內容(该注射液就是葡萄糖的水溶液).试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com