
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
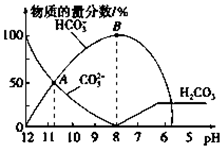 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | 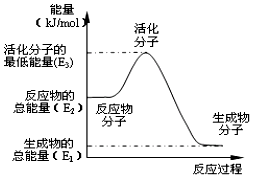 反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 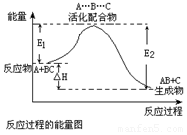 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
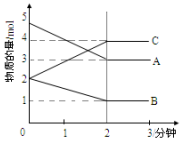 在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)
在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com