
科目: 来源: 题型:选择题
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
查看答案和解析>>
科目: 来源: 题型:解答题
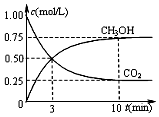 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.查看答案和解析>>
科目: 来源: 题型:实验题
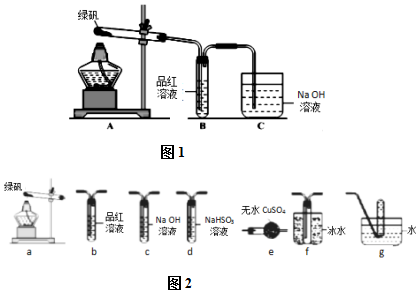
查看答案和解析>>
科目: 来源: 题型:选择题
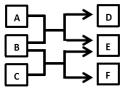 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
查看答案和解析>>
科目: 来源: 题型:选择题
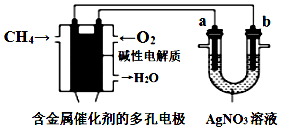
| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
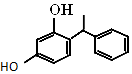 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 分子式为C14H14O2 | |
| C. | 1 mol该物质与溴水反应时最多能消耗2 mol的Br2 | |
| D. | 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钙 | B. | 硝酸钾 | C. | 高锰酸钾 | D. | 硝酸钠 |
查看答案和解析>>
科目: 来源: 题型:实验题
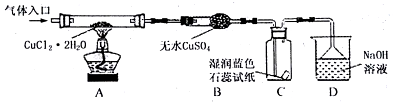
| 资料一 | CuCl2•2H2O | 在HCl气流中加热至140℃ | 产生CuCl2 | CuCl2在受热大于300℃时 | 生成CuCl和Cl2 |
| 资料二 | CuCl2•2H2O | 直接加热 | 产生Cu2(OH)2Cl2 | Cu2(OH)2Cl2在受热到200℃时 | 产生CuO |
| 步骤 | 操作描述 |
| ① | 检验装置的气密性后加药品 |
| ② | 在“气体入口”处通干燥HCl |
| ③ | 点燃酒精灯,加热 |
| ④ | 熄灭酒精灯,冷却 |
| ⑤ | 停止通入HCl,然后通入N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com