
科目: 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
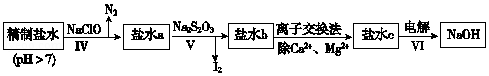
查看答案和解析>>
科目: 来源: 题型:解答题
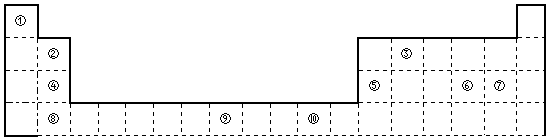
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
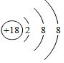 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O. .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,
,查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
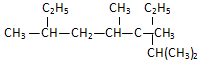 名称2,3,4,6-四甲基-3-乙基辛烷.
名称2,3,4,6-四甲基-3-乙基辛烷.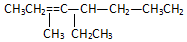 名称:2-甲基-3-乙基-1-戊烯.
名称:2-甲基-3-乙基-1-戊烯.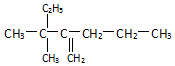 名称:3,3-二甲基-2-丙基-1-戊烯.
名称:3,3-二甲基-2-丙基-1-戊烯.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:填空题
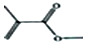
 的系统命名是2,3-二甲基-1,3-戊二烯.
的系统命名是2,3-二甲基-1,3-戊二烯.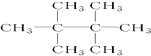 .
. .
. 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com