
科目: 来源: 题型:实验题
 .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.查看答案和解析>>
科目: 来源: 题型:选择题
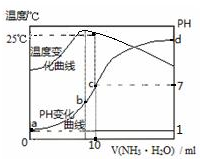
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 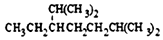 2,6-二甲基-5-乙基庚烷 | B. | 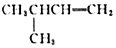 3-甲基-1-丁烯 | ||
| C. | 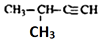 2-甲基-3-丁烯 | D. | 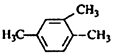 1,3,4-三甲苯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
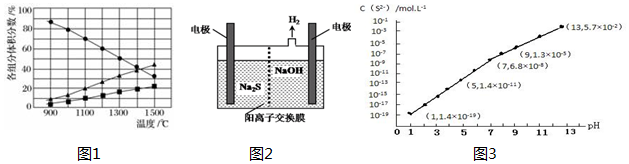
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
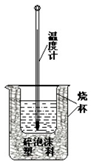 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
科目: 来源: 题型:解答题
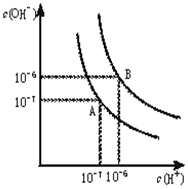 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示.查看答案和解析>>
科目: 来源: 题型:选择题
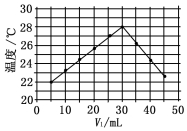 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com