
科目: 来源: 题型:解答题


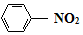 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$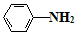 (易被氧化)
(易被氧化) $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 .
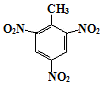
.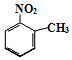 、
、
 .
.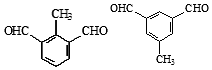 (任写一种).
(任写一种).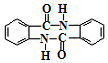 )的合成路线(无机试剂任选).
)的合成路线(无机试剂任选).
查看答案和解析>>
科目: 来源: 题型:解答题
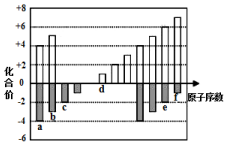 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: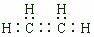 .
.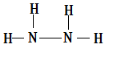 ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
查看答案和解析>>
科目: 来源: 题型:选择题


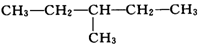
| A. | ①②和④ | B. | ②③和⑤ | C. | ①和② | D. | ④和③ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | b、c两点溶液的导电能力b>c | |
| B. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc | |
| C. | c点溶液中c(H+)=c (OH-)+c(CH3COOH) | |
| D. | a、b、c三点溶液中水的电离程度a>c>b |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题


压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com