
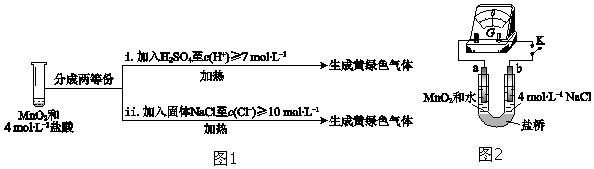
科目: 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
查看答案和解析>>
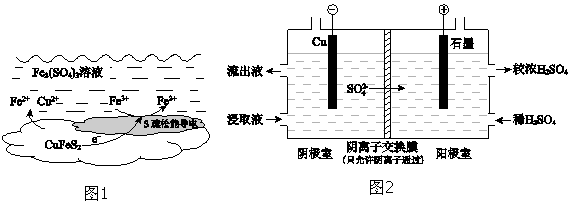
科目: 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
将铜丝压扁,掰成图案 | 将铅丹、硼酸盐等化合熔制后描绘 | 高温焙烧 | 酸洗去污 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
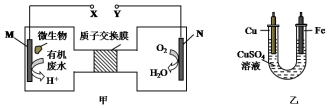
| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
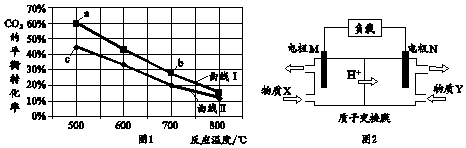
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu与Cu2S的物质的量之比为10:1 | |
| B. | 硝酸的物质的量浓度为1.2mol/L | |
| C. | Cu(OH)2沉淀质量为29.4g | |
| D. | Cu、CuS与硝酸反应后剩余HNO3为0.4mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
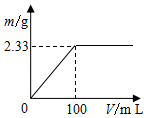 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com