
科目: 来源: 题型:选择题
| A. | 比 12C 多两个质子 | B. | 与 12C 化学性质相似 | ||
| C. | 与 12C 互为同素异形体 | D. | 质子数与中子数相等 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:实验题
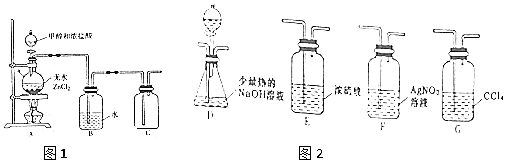
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图(夹持仪器略去),主要步骤如下:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA | |
| C. | 室温下,l L pH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| D. | 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| B. | 利用CO2合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 我国汽油标准由“国III”提高到“国1V”,目的是减少有害气体的排放,改善环境质量 |
查看答案和解析>>
科目: 来源: 题型:解答题
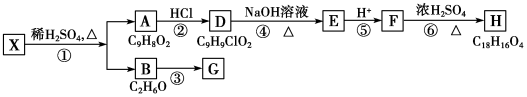
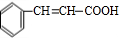 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.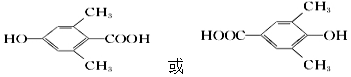 .
.查看答案和解析>>
科目: 来源: 题型:实验题
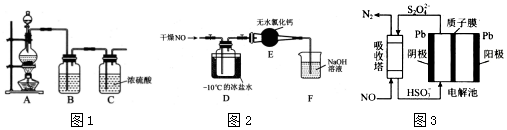
 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com