
科目: 来源: 题型:选择题
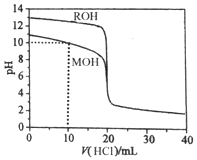
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
科目: 来源: 题型:选择题
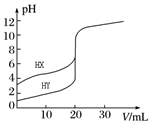 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )| A. | pH=7时,滴定HX消耗NaOH溶液体积等于20.00 mL | |
| B. | 将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH (HX) | |
| C. | 当NaOH溶液体积为20.00 mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
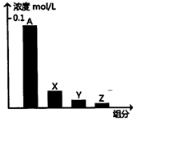 常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的乙酸与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | A可能表示Na+ | |
| B. | A可能表示乙酸分子 | |
| C. | 若图中A表示CH3COO-,可以证明乙酸是弱酸 | |
| D. | 该混合溶液中:c(A)+c(Y)=c(X)+c(Z) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
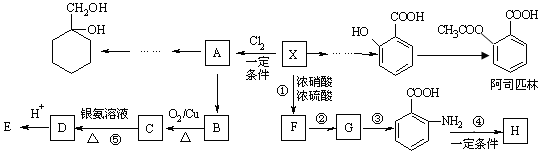

 ,反应①~⑤中属于取代反应的有①.
,反应①~⑤中属于取代反应的有①. .
.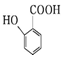 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或
(或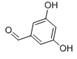 )(任写一种)
)(任写一种)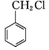 和其他无机试剂合成
和其他无机试剂合成 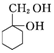 最合理的方案.
最合理的方案.查看答案和解析>>
科目: 来源: 题型:解答题
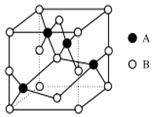 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.
氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com