
科目: 来源: 题型:选择题

| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 反应产生的热效应Q=E1-E2 | |
| C. | a与b相比,反应的平衡常数一定不同 | |
| D. | a与b相比,a的反应速率更快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的 pH 逐渐增大 | B. | 溶液中的 c(OH-)逐渐减小 | ||
| C. | 醋酸的电离程度逐渐增大 | D. | 溶液的导电能力逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯所有原子均在同一平面上 | |
| B. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应 | |
| D. | 分子式为C8H10的某芳香烃的一氯代物可能只有一种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
 | 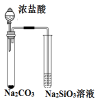 | 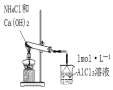 | 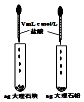 |
| 液体分层, 下层呈无色 | 判断非金属性: Cl>C>Si | 烧杯中先出现白色沉淀,后沉淀溶解 | 探究接触面积对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:rW>rZ>rY>rX | |
| B. | Z的氢化物比X的氢化物稳定 | |
| C. | X、Y、Z三种元素组成的化合物不止2种 | |
| D. | W元素氧化物对应水化物的酸性一定强于Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点Y>Q是因为Y的非金属性比Q强 | |
| B. | XM4的比例模型为  其二氢取代物有两种 其二氢取代物有两种 | |
| C. | W的氧化物,常温下可以和Z、M的氢化物反应 | |
| D. | Z的单质能将Y的单质从其氢化物中置换出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C4H8Cl2有9种同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | 乙醇、乙酸均能与NaOH 溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
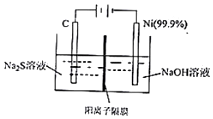 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com