
科目: 来源: 题型:选择题
| A. | 离子半径:阴离子>阳离子 | B. | 酸性:HClO4>H2SO4 | ||
| C. | 熔沸点:共价化合物>离子化合物 | D. | 稳定性:PH3>NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去苯中的甲苯,可使用酸性 KMnO4和 NaOH,然后分液 | |
| B. | 除去乙醇中混有的少量乙酸,加 NaOH 溶液,然后分液 | |
| C. | 检验溴乙烷中溴元素,直接加入硝酸银溶液生成浅黄色沉淀 | |
| D. | 实验室制备乙烯时,产生的气体直接通入溴水,溴水褪色,证明有乙烯生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 | |
| D. | 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
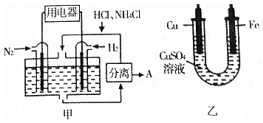 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸式滴定管和容量瓶在使用前都要用相应溶液润洗 | |
| B. | 常温下,向Fe和Cu中分别加人浓硝酸,可以比较Fe和Cu的金属活动性强弱 | |
| C. | 制取无水MgCl2固体,可将MgCl2溶液置于蒸发皿中加热蒸干 | |
| D. | 分离乙酸乙酯和饱和Na2CO3溶液可用分液的方法 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 装置 | 烧杯中的液体 | 现象(5分钟后) |
 | ①2mL1mol/LKl溶液+5滴淀粉 | 无明显变化 |
| ②2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L HCl | 溶液变蓝 | |
| ③2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L KCl | 无明显变化 | |
| ④2mL1mol/LKl溶液+5滴淀粉+2mL0.2mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
| 烧杯中的液体 | 现象(5小时后) |
| ⑤2mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
| ⑥2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com