
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
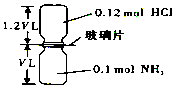 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42g | |
| C. | 生成物的分子数目为0.1NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
科目: 来源: 题型:解答题
| a | ||||||||||||||||||
| g | j | |||||||||||||||||
| b | c | f | i | l | m | |||||||||||||
| e | h | k | ||||||||||||||||
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.56L 1.8g | B. | 1.12L 3.6g | C. | 2.24L 1.8g | D. | 2.24L 3.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuO | B. | MnO2 | C. | Fe2O3 | D. | Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com