
科目: 来源: 题型:选择题
| A. | 青蒿素在水中的溶解度很小 | B. | 青蒿素含有亲脂的官能团 | ||
| C. | 在低温下提取青蒿素,效果会更好 | D. | 乙二醇提取青蒿素的能力强于乙醚 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验题
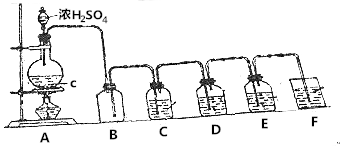 根据如图回答:
根据如图回答:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
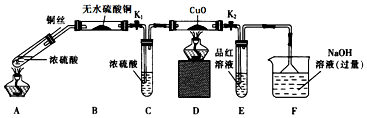
查看答案和解析>>
科目: 来源: 题型:实验题
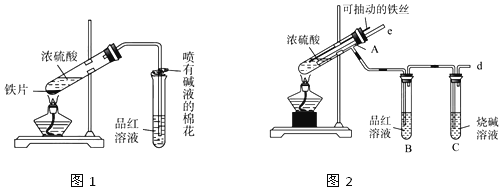
查看答案和解析>>
科目: 来源: 题型:解答题
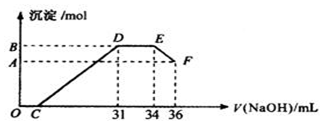
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com