
科目: 来源: 题型:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| K1 |
| K2 |
| K1 |
| K2 |
| 各物质某一状态时的物质的量浓度/mol?L-1 | ||||||
| c(CO2) | c(H2 ) | c(CO) | c(H2O ) | Qc | 平衡 | |
| ① | 0.004 | 0.004 | 0.006 | 0.006 | 已达平衡 | |
| ② | 0.062 | 0.084 | 0.039 | 0.279 | 2.09 | |
| ③ | 0.182 | 0.086 | 0.098 | 0.359 | 2.25 | |
| ④ | 0.078 | 0.142 | 0.280 | 0.120 | 平衡逆向移动 | |
查看答案和解析>>
科目: 来源: 题型:
| 10 |
| 7 |
| 10 |
| 7 |
| 5 |
| 7 |
| 5 |
| 7 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
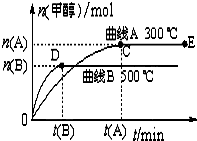 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:| 2n(B) |
| 3t(B) |
| 2n(B) |
| 3t(B) |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目: 来源: 题型:阅读理解
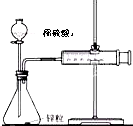 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:| 序号 | Na2S2O3溶液 | 稀H2SO4 | 出现混浊时间 | ||
| 浓度 | 用量 | 浓度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com