
科目: 来源: 题型:解答题
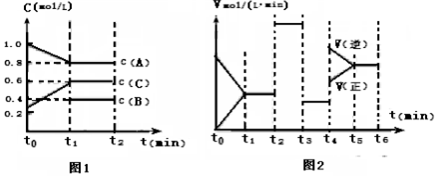
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
查看答案和解析>>
科目: 来源: 题型:实验题
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |

| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目: 来源: 题型:选择题
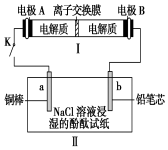 如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:
如图所示装置Ⅰ是可充电电池.已知:该充电电池充电时的反应为:| A. | 闭合开关K时,电极B上发生的反应是:Br3-+2e-═3Br- | |
| B. | 闭合开关K时,I中Na+移向A极,II中Na+移向a极 | |
| C. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL | |
| D. | 闭合开关K时,Ⅱ中发生反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的分子式为C5H10O2 | |
| B. | X可能的结构有两种 | |
| C. | Y中含有的官能团有羧基和碳碳双键 | |
| D. | X与Y相对分子质量相差14,则X与Y互为同系物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若X为IA族时,Y不可能是第三周期VIA族元素 | |
| B. | 由X、Y、Z、W四种元素不可能形成其原子个数比为1:3:1:1的化合物 | |
| C. | Z元素的原子半径一定小于W元素的原子半径 | |
| D. | 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
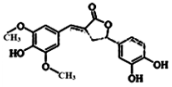 天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )
天然有机化合物甲的结构简式如图,该物质具有一定的除草功效,有关该化合物的说法正确的是( )| A. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 | |
| B. | 1 mol该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含5 mol Br2的浓溴水反应 | |
| D. | 该化合物分子中含有三种含氧官能团 |
查看答案和解析>>
科目: 来源: 题型:选择题
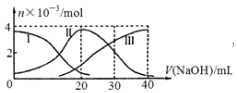 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com