
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 原溶液中一定含有SO42- |
| B | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
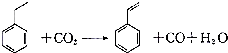 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 苯乙烯分子中含有4个碳碳双键 | B. | 苯乙烯分子式为C8H10 | ||
| C. | 乙苯有三种同分异构体 | D. | 乙苯能发生取代、加成和氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa时,11.2L氮气所含的原子数目为NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有的离子总数为0.3NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1molP4和1molCH4中含有的共价健数均为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 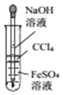 用所示装置制取并观察Fe(OH)2 | |
| B. | 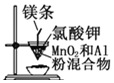 用所示装置制取金属锰 | |
| C. | 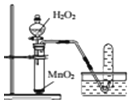 用所示装置制取干燥的O2 | |
| D. | 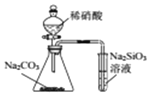 用所示装置比较N、C、Si的非金属性强弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | 酸性:H2SiO3>H2CO3 |
| C | 向氯化铝溶液中滴加氢氧化钠溶液,观察到先产生白色沉淀后沉淀溶解 | 氢氧化铝可溶于强碱 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点髙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通过化学变化可实现${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的相互转化 | |
| B. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H的核外电子排布方式相同,化学性质相同 | |
| C. | ${\;}_{1}^{2}$H与${\;}_{1}^{1}$H核外电子数和中子数均为1 | |
| D. | ${\;}_{1}^{2}$H与H2互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
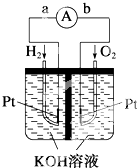
| A. | 放电时负极反应为:MH+OH--e-═M+H2O | |
| B. | 放电时,每转移1mol电子,有1mol NiOOH被氧化 | |
| C. | 充电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车 | |
| B. | 高纯硅可以将太阳能直接转化为电能 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 工业上Cl2用与石灰乳反应制备漂白粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com