
科目: 来源: 题型:选择题
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)=10-7mol•L-1 | |
| B. | 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3 | |
| C. | 常温下0.1mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10-10mol•L-1 | |
| D. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向0.2mol•L-1CH3COOH溶液中加入等体积0.1mol•L-1NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 | |
| B. | 向0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时溶液pH=a,则由水电离产生的c(OH-)=10a-14mol•L-1 | |
| C. | 将0.1 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液有:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) | |
| D. | 对于难溶电解质:相同温度时,Ksp大的饱和溶液的物质的量浓度一定比Ksp小的饱和溶液物质的量浓度大 |
查看答案和解析>>
科目: 来源: 题型:选择题
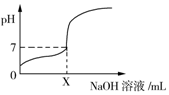 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Na2O2(s)+2CO2( s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| B. | CO的燃烧热为283 kJ | |
| C. | 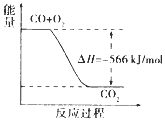 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×l023 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
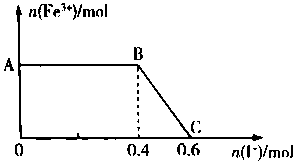 将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:
将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
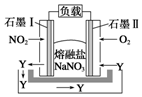 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1) | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)=C(Na+) | |
| C. | 丙中:若HA是弱酸,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 丁中:若 c=9,则c(OH-)-c(HA)=10-9mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com