
科目: 来源: 题型:选择题
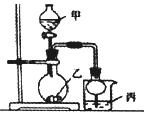
| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红红褪色 |
| B | 浓盐酸 | KMnO4 | 淀粉-Kl溶液 | 溶液变蓝 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 化合物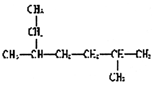 的名称为2-甲基-5-乙基己烷 的名称为2-甲基-5-乙基己烷 | |
| C. | 纤维素和油脂都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸保存在棕色橡胶塞的试剂瓶中 | |
| B. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 | |
| C. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| D. | 配制NH4Fe(SO4)2标准溶液时,加入一定量HCl以防水解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 136g熔融的KHSO4中含有2NA个阳离子 | |
| B. | 40gH218O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
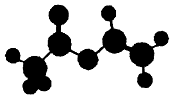 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com