
科目: 来源: 题型:选择题
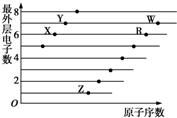 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同一周期元素形成的简单离子的半径从左到右依次减小 | |
| B. | 主族元素的最高正价均等于其族序数 | |
| C. | 元素的非金属性、金属性与元素原子在氧化还原反应中得失电子数目的多少无关 | |
| D. | 元素的非金属性越强,其气态氢化物的还原性越弱,其气态氢化物的酸性也越弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目: 来源: 题型:推断题
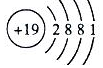

 、
、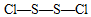 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
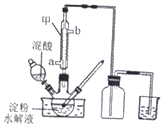 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取、性质及应用,进行如下实验.| 编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-l | 体积/mL | ||
| 甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| 乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| 丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:W>Z | |
| B. | X和W形成的化合物属于离子化合物 | |
| C. | 由X、Y、Z三种元素组成化合物的水溶液一定显酸性 | |
| D. | Z最简单氢化物分子间存在氢键,故其稳定性强于Y最简单氢化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 乙酸乙酯和甘油(丙三醇) | D. | 食盐水和泥沙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com