
科目: 来源: 题型:实验题
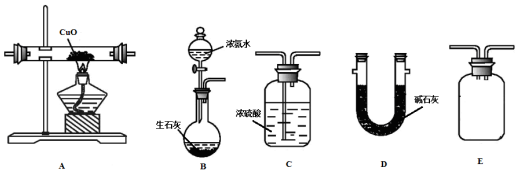
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量数是89 | B. | 质子数与中子数之差为50 | ||
| C. | 核外电子数是39 | D. | ${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y互为同位素 |
查看答案和解析>>
科目: 来源: 题型:解答题
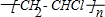 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性:乙>丙 | |
| B. | 简单气态氢化物的稳定性:丁>甲 | |
| C. | 简单离子半径:乙>丙>丁 | |
| D. | 甲和乙组成的化合物只存在离子键 |
查看答案和解析>>
科目: 来源: 题型:解答题
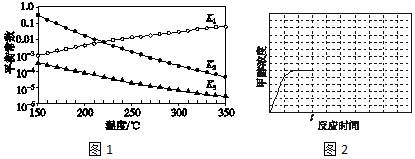
查看答案和解析>>
科目: 来源: 题型:实验题
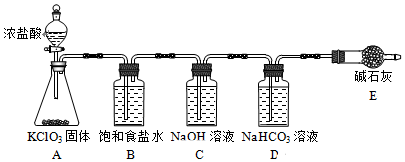
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
查看答案和解析>>
科目: 来源: 题型:解答题
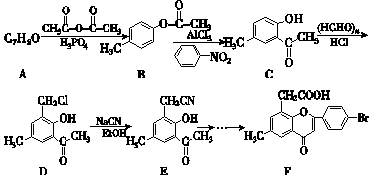
 +2NaOH→
+2NaOH→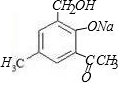 +H2O+NaCl.
+H2O+NaCl.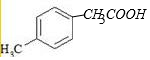 .
.查看答案和解析>>
科目: 来源: 题型:解答题
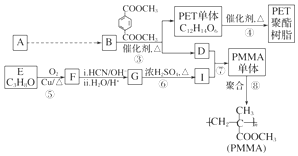
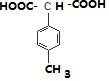 ,
, ,
,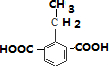 ,
, .
.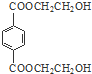 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com