
科目: 来源: 题型:解答题
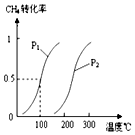 在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H
在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H查看答案和解析>>
科目: 来源: 题型:解答题
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稳定性:HI>HCl | B. | 熔、沸点:HI>HCl | ||
| C. | 同浓度的HI和HCl的酸性:HI>HCl | D. | 还原性:HI>HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |
查看答案和解析>>
科目: 来源: 题型:解答题
 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多 | |
| B. | C与D的最高价氧化物对应的水化物的碱性相比,后者更强 | |
| C. | 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高 | |
| D. | 简单离子半径:B<C |
查看答案和解析>>
科目: 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:X<T<Z | ||
| C. | 气态氢化物的还原性:X<T<R | D. | 最高价氧化物的水化物酸性:Q<T<R |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③④ | C. | ②③④⑤ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com