
科目: 来源: 题型:选择题
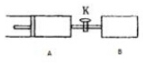 如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )| A. | 两容器中的反应分别达到平衡时,反应物X的速率:v(B)>v(A) | |
| B. | A容器中x的转化率为80% | |
| C. | 平衡时的压强:PA<PB | |
| D. | 平衡时Y体积分数:A>B |
查看答案和解析>>
科目: 来源: 题型:选择题
| 检验操作 | 现象 | 结论 | |
| A | 加入盐酸酸化的氯化钡 | 产生白色沉淀 | 一定有 SO42- |
| B | 加入氯水与四氯化碳 | 有机层呈紫色 | 一定有 I- |
| C | 加入足量稀盐酸 | 产生无色气体 | 一定有 CO32- |
| D | 加入硝酸银 | 产生白色沉淀 | 一定有 Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
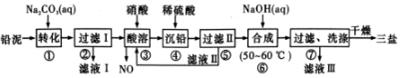
查看答案和解析>>
科目: 来源: 题型:解答题
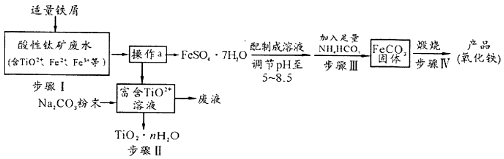
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:c>d | |
| B. | a、b、c、d中,d的原子半径最大 | |
| C. | a与b、c形成的化合物可能含有非极性键 | |
| D. | a与其它元素形成的化合物均为共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | 原子最外层电子数:W>Z>Y | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 由X、Y、Z三种元素形成的化合物的水溶液一定显酸性 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
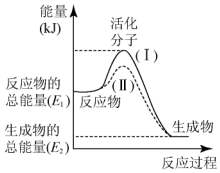 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com