
科目: 来源: 题型:选择题
| A. | C与氧元素形成的化合物一定属于碱性氧化物 | |
| B. | 最高价氧化物对应的水化物的酸性:E>D>A | |
| C. | 简单氢化物的沸点:E>B | |
| D. | 原子半径:C>D>E |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用长颈漏斗分离汽油和水的混合液 | |
| B. | 酒精灯使用不当引起少量酒精在桌上燃烧时,立即用湿布盖灭 | |
| C. | 给盛有液体的试管加热时,要不停地移动试管 | |
| D. | 洗净的锥形瓶和容量瓶可用烘箱烘干 |
查看答案和解析>>
科目: 来源: 题型:选择题
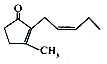
| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 燃煤中加人生石灰可降低含硫化合物的排放 | |
| B. | 可用淀粉溶液检验食盐中是否加碘 | |
| C. | 酿酒工业中使用的“酒曲”是一种酶 | |
| D. | 可用蒸馏法、电渗析法淡化海水 |
查看答案和解析>>
科目: 来源: 题型:选择题
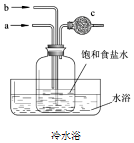
| A. | 先从b管通入NH3再从a管通入CO2 | B. | 先从a管通入CO2再从b管通入NH3 | ||
| C. | 广口瓶内有白色沉淀析出 | D. | c中试剂为碱石灰 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单的离子半径:W>Z>Y>X | |
| B. | 五种元素中只有X存在同素异形体 | |
| C. | W和M形成的化合物是离子化合物 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | C. | 乙酸乙酯和乙酸 | D. | 食盐水和泥沙 |
查看答案和解析>>
科目: 来源: 题型:实验题
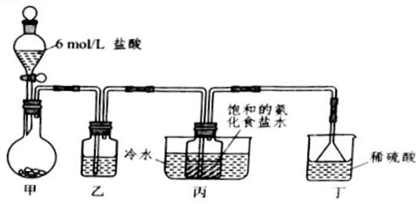
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com