
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:推断题
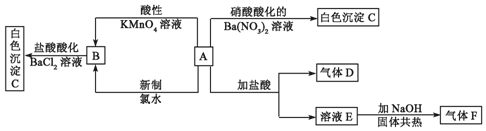
 ;F的结构式
;F的结构式 ;
;查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 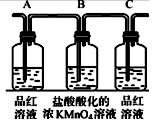 |  |  | 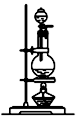 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
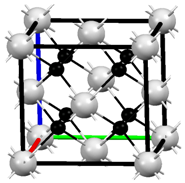 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2 | B. | HCOOH | C. | C6H12O6 | D. | C12H22O11 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60g丙醇含有的共价键数目为10NA | |
| B. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| C. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| D. | 80ml10mol/L盐酸与足量MnO2加热反应,产生Cl2的分子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L0.1mol•L-1的酒精溶液中含氢原子数为0.6NA | |
| B. | 常温常压下,1L1L0.1mol•L-1的醋酸铵溶液中含氮原子数目为0.1NA | |
| C. | 1mol有机物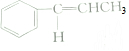 中含有5NA和碳碳双键 中含有5NA和碳碳双键 | |
| D. | 1mol甲基(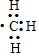 )所含的电子数为7NA )所含的电子数为7NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com