
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
查看答案和解析>>
科目: 来源: 题型:实验题
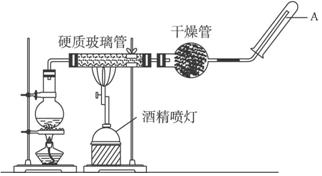 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
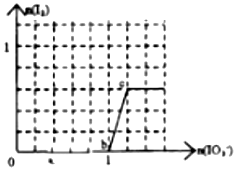 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
查看答案和解析>>
科目: 来源: 题型:推断题
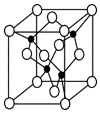 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
.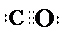 .
.查看答案和解析>>
科目: 来源: 题型:选择题
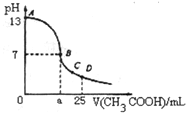 室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )
室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )| A. | 在A、B间任意一点,溶液中一定都有c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 在B点:a>12.5,且有c(Na+)═c(CH3COO-)=c(OH-)═c(H+) | |
| C. | 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 在D点:c(CH3COO-)=c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com