
科目: 来源: 题型:选择题
 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )| A. | ZX2为酸性氧化物,只能与碱溶液反应 | |
| B. | 简单氢化物的热稳定性:Z<W | |
| C. | 化合物YWX中既含离子键,又含共价键 | |
| D. | W的最高价氧化物对应的水化物为强酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 原子半径:W>X>Y | |
| B. | 化合物WY2不溶于水 | |
| C. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 | |
| D. | 最高价氧化物对应水化物的酸性:W<Z |
查看答案和解析>>
科目: 来源: 题型:实验题
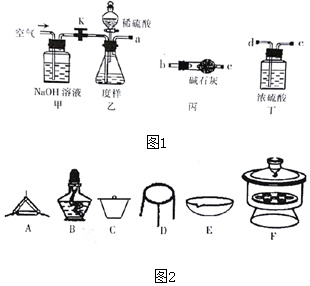
查看答案和解析>>
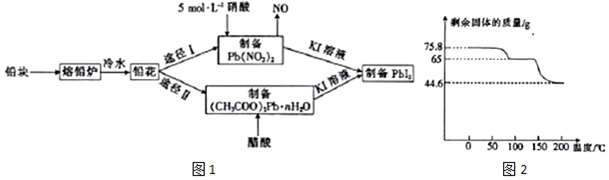
科目: 来源: 题型:解答题
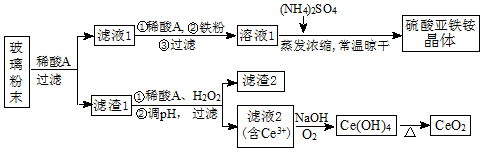
查看答案和解析>>
科目: 来源: 题型:选择题
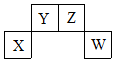 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )| A. | X的单质投入冷浓硫酸中剧烈反应 | |
| B. | 几种最低价气态氢化物稳定性:Z>W | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物对环境有污染,Y的氧化物没有污染 |
查看答案和解析>>
科目: 来源: 题型:解答题
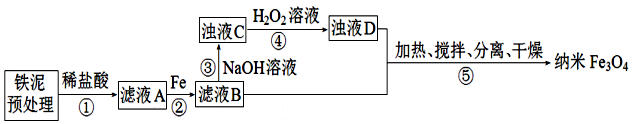
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| C | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| B. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为4NA | |
| C. | 常温下,2L 0.1 mol•L-1FeCl3 溶液与 1L 0.2 mol•L-1FeCl3 溶液所含 Fe3+数目不同 | |
| D. | 100g质量分数为46%的乙醇溶液中含有NA个-OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com