
科目: 来源: 题型:解答题
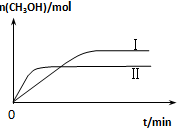 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
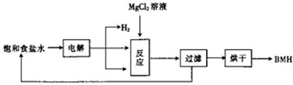 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蔗糖与纤维素均属于高分子化合物 | |
| B. | 不同的油脂发生皂化反应,至少有一种产物相同 | |
| C. | 淀粉在稀硫酸作用下充分加热后,所得溶液与少量新制Cu(OH)2共热未见红色沉淀,说明淀粉未发生水解 | |
| D. | 蛋白质溶液中加入酒精后会发生盐析而失去生理活性 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
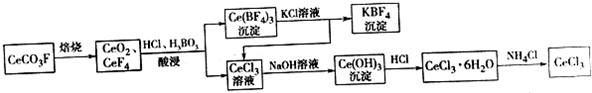
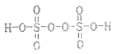 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合后溶液呈酸性,则:c(HSO3-)>c(SO32-) | |
| B. | 0.1mol•L-1的CH3COONa溶液20mL与0.1mol•L-1的稀盐酸10mL混合后溶液显酸性:c(CH3COO-)>c (Cl-)>c(H+)>c(CH3COOH) | |
| C. | c(NH4+)浓度相同的NH4Cl、(NH4)2SO4、(NH4)2CO3溶液中,溶质的物质的量浓度:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) | |
| D. | 0.1mol•L-1NaNO3溶液与0.1mol•L-1CH3COOH溶液以任意比例混合:c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O. | |
| B. | 硝酸银溶液和过量的氨水反应:Ag++3NH3•H2O═Ag(NH3)2OH+NH4++2H2O | |
| C. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 碳酸钠溶液中加入过量苯酚: +CO32-→ +CO32-→ +HCO3- +HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com